Конспект занятия спецкурса по химии «Подготовка к ЕГЭ»
Тема занятия спецкурса «Подготовка к единому государственному экзамену»: Стехиометрические расчёты в химии
Автор: Десяткин Александр Афанасьевич, учитель химии школы №1 с. Новобелокатай Белокатайского района Республики Башкортостан.Описание материала: Предлагаю вам конспект занятия спецкурса по химии «Подготовка к единому государственному экзамену» для учащихся 10-11 классов по теме: «Стехиометрические расчеты в химии». Данный материал будет полезен учителям и учащимся для подготовки к выполнению заданий единого государственного экзамена, связанных со стехиометрическими расчетами.
Цель: Подготовка к единому государственному экзамену, формирование главных понятий стехиометрии и навыков решения задач на «вывод химической формулы», изучение химического языка (символов), правил составления химических формул веществ, написания уравнений химических реакций, применение стехиометрических законов химии.
Задачи: расширить знания учащихся о способах решения задач, закрепить навыки работы с алгоритмами, показать взаимосвязь химии и математики.
Оборудование: проектор, экран, раздаточный материал – алгоритм по решению задач, общие формулы веществ разных классов.
Ход занятия
I. Организационный моментУчитель знакомит класс с темой занятия, целью и задачами занятия. На едином государственном экзамене в задание 35 проверяются умения по установлению молекулярной и структурной формулы вещества.
Обычно решение этих задач не представляет особых сложностей, однако часто выпускники теряют баллы на этой задаче.
Причины:
• Неверно составленная общая формула вещества;
• Решение не математическим путем, а методом подбора;
• Ошибки в уравнении реакции с участием вещества, записанного в общем виде;
• Некорректное оформление.
Так как химия наука точная, она неразрывно связана с различного рода вычислениями. Чтобы решать задачи, нужно знать формулы и хорошо в них ориентироваться. Без этих базовых знаний и навыков изучение химии становится невозможным.
Сегодня на занятие мы повторим основные химические формулы, изучаемые в школьном курсе химии. Они пригодятся каждому ученику, особенно тем, кто будет сдавать единый государственный экзамен по химии.
Знание расчётных формул – это ключевой момент при решении задач. Главное, понимать их, а не бездумно заучивать. Так как они будут использоваться не только в школьных задачах, на едином государственном экзамене и основном государственном экзамене, но и в дальнейшей жизни, даже если ваша профессиональная сфера будет далека от химии.
Осмысленному пониманию и как, следствие, правильному решению задачи, способствуют иллюстрации к заданию. Они являются схематическим отображением явлений и процессов, а также объектов, рассматриваемых в данной задаче. При этом записывают формулы и цифровые значения величин, отражающие количественные соотношения между искомой величиной (объектом) и другими составными частями (данными задачи). Зрительное представление происходящего процесса помогает разобраться в них, понять смысл задачи.
За правильное выполненное задание 35 можно получить 3 балла. На решение отводится примерно 10-15 минут.
II. Типы задач в задании 35
1. Определение формулы вещества по массовым долям химических элементов или по общей формуле вещества;
2. Определение формулы вещества по продуктам сгорания;
3. Определение формулы вещества по химическим свойствам.
Все перечисленные типы задач мы разберем на наших занятиях, а сегодня остановимся на основных теоретических сведениях, необходимых для решения задач.
III. Необходимые теоретические сведения для решения задач.
1. Массовая доля элемента в веществе.
Массовая доля элемента — это его содержание в веществе в процентах по массе.
Если записать эту формулу в общем виде, то получится следующее выражение:
w(элемента) = (n• Ar(элемента) • 100%) / Mr(вещества)
где: w – массовая доля элемента в веществе, n– индекс в химической формуле, Ar–относительная атомная масса, Mr– относительная молекулярная масса вещества.
Массовые доли выражают в процентах или в долях: w(элемента) = 20% или 0,2.
Например, в веществе состава С2Н4 содержится 2 атома углерода и 4 атома водорода. Если взять 1 молекулу такого вещества, то его молекулярная масса будет равна: Mr(С2Н4)=2.12 +4.1 =28 а.е.м. и там содержится 2.12 а.е.м. углерода.
Чтобы найти массовую долю углерода в этом веществе, надо его массу разделить на массу всего вещества: W(C)=12.2/28 = 0,857 или 85,7%.
Если вещество имеет общую формулу СхНyOz, то массовые доли каждого их атомов так же равны отношению их массы к массе всего вещества. Массa X атомов С равна – 12Х, масса Y атомов H -Y, масса Z атомов кислорода – 16Z. Тогда W(C)= 12X/(12X+Y+16Z)
2. Молекулярная и простейшая формула вещества. Молекулярная (истинная) формула — формула, в которой отражается реальное число атомов каждого вида, входящих в молекулу вещества.
Например, C2H4 — истинная формула этилена.
Простейшая (эмпирическая) формула — показывает соотношение атомов в веществе.
Например, для бензола соотношение С:Н = 1:2 , т.е. простейшая формула этилена — СН2.
Молекулярная формула может совпадать с простейшей или быть кратной ей.
Примеры.
Вещество Молекулярная формула Соотношение атомов Простейшая формула
Метанол СН4О С:Н:О = 1:4:1 СН4О
Пропен С3Н6 С:Н = 1:2 СН2
Уксусная кислота С2Н4О2 С:Н:О = 1:2:1 СН2О
Если в задаче даны только массовые доли элементов, то в процессе решения задачи можно вычислить только простейшую формулу вещества. Для получения истинной формулы в задаче обычно даются дополнительные данные — молярная масса, относительная или абсолютная плотность вещества или другие данные, с помощью которых можно определить молярную массу вещества.
3. Относительная плотность газа
Это отношение называется относительной плотностью D ( или d) одного газа по другому.
D – показывает во сколько раз один газ тяжелее или легче другого и является безразмерной величиной.
Например,
DO2 (газа)= Mr(газа)/Mr(O2)=Mr(газа)/32;
DH2 (газа)= Mr(газа)/Mr(H2)=Mr(газа)/2;
Dвоздуха (газа)= Mr(газа)/Mr(воздуха)=Mr(газа)/29.
4. Абсолютная плотность газа при нормальных условиях.
Абсолютная плотность газа — это масса 1 л газа при нормальных условиях. Обычно для газов её измеряют в г/л.
= m(газа) / V(газа)
Если взять 1 моль газа, то тогда:
= М / Vm (Vm = 22,4 л/моль), а молярную массу газа можно найти, умножая плотность на молярный объём.
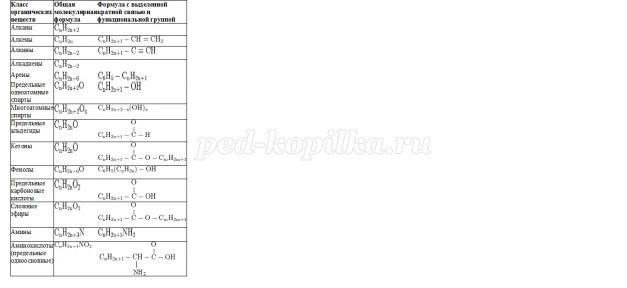
5. Общие формулы веществ разных классов.
Часто для решения задач с химическими реакциями удобно пользоваться не обычной общей формулой, а формулой, в которой выделена отдельно кратная связь или функциональная группа.
Класс органических веществ Общая молекулярная формула Формула с выделенной кратной связью и функциональной группой
IV. Алгоритм решения подобных заданий.
1) Определяем общую формулу гомологического ряда, к которому относится соединение Х.
2) Записываем реакцию исследуемого вещества Х с реагентом Y.
3) По массе Y (или конечного вещества Z) находим его количество.
4) По количеству Y или Z делаем вывод о количестве Х.
5) Зная массу Х и его кол-во, рассчитываем молярную массу исследуемого вещества.
6) По молярной массе X и общей формуле гомологического ряда можно определить молекулярную формулу Х.
7) Записываем ответ.
V. Подведение итогов.
На следующих занятиях мы будем решать задачи на нахождение молекулярной и структурной формулы вещества опираясь на теоретические сведения, которые повторили и обобщили сегодня.
Рефлексия.
Дайте ответы на вопросы:
1. Что узнали нового на занятие?
2. Что было для вас знакомым?
3. Какие теоретические сведения (понятий стехиометрии) дались легко, а какие с затруднением?
VI. Домашнее задание.
Повторить основные понятия стехиометрии.
Скачать Стехиометрические расчёты в химии
Рекомендуем посмотреть:
 Уроки химии для 1 курса колледжа
Уроки химии для 1 курса колледжа
 ФГОС тестовый контроль по дисциплине Биология для студентов колледжа. Учение о клетке
ФГОС тестовый контроль по дисциплине Биология для студентов колледжа. Учение о клетке
 Конспект урока химии для 11 класса. Факторы, влияющие на скорость химических реакций
Конспект урока химии для 11 класса. Факторы, влияющие на скорость химических реакций
 Конспект урока химии для 11 класса. Химия в жизни человека
Конспект урока химии для 11 класса. Химия в жизни человека
Похожие статьи:
Игра по химии с ответами, 10-11 класс
Конспект урока химии для 10 класса по теме «Изучение метанола и этанола»
|
|
0 Голосов: 0 |
Нет комментариев. Ваш будет первым!



