Конспект урока по химии, 9 класс. Сера
Конспект урока по химии (9 класс). Тема «Сера»
Перед вами конспект урока по теме «Сера». Данный конспект рассчитан на учащихся 9 классов. Он подойдет для работы, как учителям, так и учащимися, которые отстали от класса.Тема: «Сера»
Цель урока: Учащиеся должны изучить строение атома, валентные возможности серы, его аллотропные модификации, физические и химические свойства; способы получения, нахождение в природе.
Дидактические задачи:
Обучающая:
- Учащиеся должны закрепить умение писать электронные конфигурации атомов на примере написания электронной конфигурации атома серы, понимать, почему валентные возможности серы могут быть равны 4 и 6.
- Учащиеся должны повторить понятие «аллотропия», изучить аллотропные модификации серы (ромбическая, моноклинная, пластическая), понимать их взаимосвязанность.
- Изучить способ получения серы. Закрепить умение написания уравнений ОВР и составления электронного баланса при изучении химических свойств серы.
Развивающая: Учащиеся должны уметь применять имеющиеся знания при изучении новой темы, при характеристике химических свойств
Воспитывающая:
- Учащиеся должны понимать практическую значимость серы;
- продолжить формирование у учащихся познавательного интереса к химии путем изучения темы «Сера»
Основные понятия темы: Угарный газ, углекислый газ, физические и химические свойства оксидов углерода, качественная реакция на углекислый газ, угольная кислота, карбонаты, гидрокарбонаты.
Основные понятия: генетический ряд металлов и неметаллов
Оборудование: Интерактивная доска, компьютер, проектор
Метод обучения: Словесно-наглядный
Тип урока: Урок изучения нового знания.
Средства обучения: Учебник, презентация
План урока:
I этап. Организационный момент (1 минута)
II этап. Проверка домашнего задания (5 минут)
III этап. Актуализация и целеполагание. (5 минут)
IV этап. Процесс изучения нового знания (25 минут)
V этап. Первичное закрепление (7 минут)
VI этап. Рефлексия (1 минута)
VII этап. Домашнее задание (1 минута)
Ход урока
I. Приветствие, проверка готовности учащихся к урокуII. Актуализация знаний
1. Повторить общую характеристику элементов подгруппы галогенов
- К какому типу химических элементов относятся кислород? (неметаллы)
- Сколько электронов на внешнем уровне у атомов кислорода? (6)
- Какая наиболее характерная степень окисления? (-2), почему? (до завершения энергетического уровня не хватает 2 электрона)
- Может ли кислород проявлять степень окисления равную номеру группы? (нет) почему?
- Может ли кислород проявлять положительную степень окисления? (OF2) почему?
2. Какой объем кислорода потребуется для сжигания 209 г серы, содержащей 17% примесей?
III. Целеполагание
О каком веществе идёт речь?
Известно, что в морском бою против арабов византийцы впервые применили новое оружие – греческий огонь. Галеры византийцев выбрасывали на судна неприятелей заранее подожжённую смесь из «Пифонов». Суда пылали как факелы, а огонь нельзя было потушить водой. Под стенами Царьграда «греческим» огнём был уничтожен флот киевского князя Игоря. Строки летописи в переводе звучат так: «Словно молнию, которая в небе, греки имеют у себя и пускают ее, сжигая нас, поэтому мы не одолели их». В состав греческого огня входила нефть, а так же неизвестный элемент. Этот неметалл на воздухе горит сине-голубым пламенем, выделял удушливый и едкий газ.
Тема урока: сера
IV. Этап изучения нового знания
1. Общая характеристика элементов VIA группы
Запишите на доске общую характеристику элементов VIA группы кислорода и серы (строение атома, электронную и электронографическую формулы)
- Какие элементы составляют VIA группу?
- Как изменяются по группе сверху вниз свойства элементов VI группы?
- Что представляют собой при обычных условиях простые вещества, образованные элементами VIA группы?
- Какое общее название элементов VI группы? (халькогены)
2. Сера. Строение атома, общая характеристика
- Какая валентность характерна для серы?
- Почему кислород не имеет валентности 4 и 6?
- Какие степени окисления может проявлять сера? (-2, 0, +4, +6)
3. Аллотропные модификации, физические свойства.
- Что такое аллотропия?
- Какие аллотропные модификации образует сера?
В свободном виде образует три аллотропные модификации: ромбическая, моноклинная, пластическая.
Сера в свободном виде образует несколько аллотропных модификаций.
Информационный текст
Самой устойчивой модификацией является ромбическая сера. Плотность этой формы равна 2,07 г/см3. Форма кристалла – октаэдрическая. Вторая по прочности моноклинная модификация серы, имеющая иглоподобные длинные кристаллы. Плотность этой формы равна 1,96 г/см3. Пластическая сера представляет собой замкнутые или открытые цепи соединяющейся между собой серы. Все аллотропные модификации серы хорошо растворимы в неполярных органических растворителях.
- Заполните таблицу
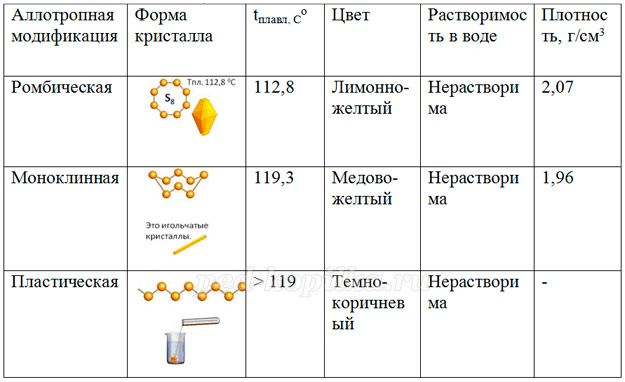
- Какие физические свойства характерны для серы?
Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается (плавает на поверхности), t кип= 445°С.
4. Нахождение в природе
Сера довольно широко распространена в природе. Её содержание в земной коре составляет 0,048 %.Значительная часть серы встречается в самородном состоянии. Также сера встречается в форме сульфидов: пирит, халькопирит и сульфатов: гипс, целестин и барит.
5. Химические свойства серы.
- Какие свойства проявляет сера в ОВР? Каковы ее возможные степени окисления
S (-2) – S (0) – S (+4) – S (+6)
I.с простыми веществами
1. С металлами (Кроме Au, Pt, Ir)
2Na+S=Na2S
2Al + 3S =Al2S3
Zn + S = ZnS
Сера проявляет свойства окислителя
2. С неметаллами (как окислитель)
H2+ S= H2S
2P + 3S= P2S3
C + 2S= CS2
С неметаллами (как восстановитель)
-С кислородом
S + O2 =SO2 (сернистый газ)
Этот вредный для здоровья человека газ является причиной кислотных осадков (дожди, туманы, снег), наносящих вред всему живому.
В колбу с водой по каплям добавляем лакмус. В ложку для сжигания веществ помещаем небольшое количество серы, поджигаем и опускаем в колбу (ложка не касается воды). Образующийся диоксид серы соединяется с парами воды, лакмус краснеет.
-С галогенами (кроме йода):
S+Cl2=SCl2
II. Со сложными веществами
1. С кислотами-окислителями
S + 2H2SO4(конц)= 3SO2+ 2H2O
S + 6HNO3(конц)= H2SO4+ 6NO2+ 2H2O
2.Со щелочами:
3S + 6KOH = K2S+4O3+ 2K2S + 3H2O
V этап. Первичное закрепление
1) Заполните пробелы в утверждениях
1. Сера - элемент …….. группы ……….. подгруппы.
2. Заряд ядра атома серы равен …….
3. В ядре атома серы содержится …… протонов, …… нейтронов, ….. электронов.
4. Атомы серы имеют на внешнем уровне ….. электронов.
5. Сера имеет степень окисления в соединениях с металлами ……. и является в ходе химической реакции …………..
6. Аллотропные модификации серы: …………….
2) С какими из перечисленных веществ будет реагировать сера? Напишите уравнения все возможных реакций.
нитрат алюминия, магний, кислород, сульфит калия, водород, гидроксид бария, серная кислота, бром.
3) Какая масса сульфида цинка образуется при взаимодействии 6 г серы с цинка.
VI этап. Рефлексия
Подумайте и закончите предложения:
– Сегодня на уроке я узнал…
– На уроке я понял…
– Теперь я знаю как…
VII этап. Домашнее задание
Скачать Конспект урока по химии (9 класс). Тема «Сера»
Рекомендуем посмотреть:
 Конспект урока химии 9 класс. Кислородные соединения углерода
Конспект урока химии 9 класс. Кислородные соединения углерода
 Конспект урока химии для 9 класса. Серная кислота
Конспект урока химии для 9 класса. Серная кислота
 Конспект урока химии для 9 класса
Конспект урока химии для 9 класса
 Тестовые задания по химии, 9 класс. Галогены и их свойства
Тестовые задания по химии, 9 класс. Галогены и их свойства
Похожие статьи:
Методическая разработка урока химии 9 класс
Конспект урока химии для 9 класса
Практические работы по химии 9 класс
|
|
Автор: Элнара Бахруз кызы Абдулаева
Опубликовано: 1246 дней назад (23 июня 2021)
Просмотров: 3301
Рубрика: Без рубрики
|
0 Голосов: 0 |
Нет комментариев. Ваш будет первым!




